

| Andere Bezeichnung(en): | Hydroxylammoniumchlorid; engl.: Hydroxylamine hydrochloride; frz.: hydrochlorure d´hydroxylamine |
| Summenformel; Linienformel: | H4ClNO; NH2OH x HCl; [NH3OH]Cl |
| Strukturformel: | 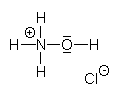 |
| Relative Molmasse: | 69,49 g/mol |
| CAS-Nummer: | [5470-11-1] |
| EWG-Nr./EINECS-Nr.: | 226-798-2 |
Beschreibung, Eigenschaften:
Bei der Substanz handelt es sich um farblose Kristalle oder um ein weißes, kristallines Pulver, das sich in Wasser sehr leicht auflöst. Hydroxylamin-hydrochlorid ist auch in Ethanol löslich. Der Schmelzpunkt liegt weitaus höher als beim Hydroxylamin selbst (151° gegenüber 33 °C); auch ist das Hydrochlorid gegenüber thermischer Einwirkung wesentlich stabiler.
Verwendung
Als häufig gebrauchtes Reagenz, vor allem zur Überführung von Carbonylverbindungen (Aldehyde oder Ketone) in ihr Oxim. Der Stoff kann deshalb zur quantitativen Bestimmung der Carbonylfunktion von Aldehyden und Ketonen dienen, auch in Mischungen (sog. "Oximtitration", Beispiel: Analytik ätherischer Öle, wie Kümmelöl, Zimtöl, Zitronenöl usw.). Die Carbonylgruppe angreifendes Agens ist die Stickstoffbase Hydroxylamin:
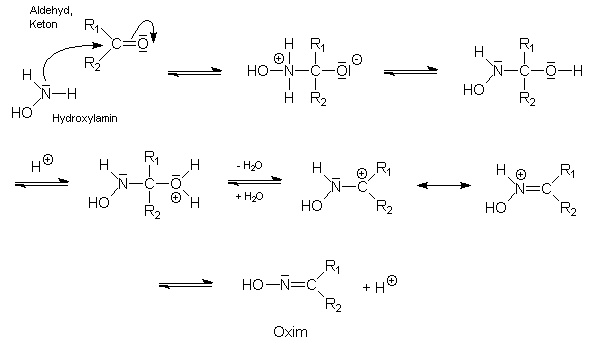
Die Oximbildung wird also durch Säuren katalysiert;
dabei hat sich herausgestellt, daß die Umsetzung am wirksamsten von einer Säure mit der
Acidität des [H3NOH]![]() - Kations
unterstützt wird. Aus diesem Grund setzt man bevorzugt Hydroxylamin-hydrochlorid zur
Oximbildung ein. Man verwendet bei der praktischen Durchführung einen Überschuß
Hydroxylamin. Bei der Reaktion mit einer Carbonylgruppe wird eine genau äquivalente Menge
an Protonen frei (Oxime sind sehr schwache Basen!) nach:
- Kations
unterstützt wird. Aus diesem Grund setzt man bevorzugt Hydroxylamin-hydrochlorid zur
Oximbildung ein. Man verwendet bei der praktischen Durchführung einen Überschuß
Hydroxylamin. Bei der Reaktion mit einer Carbonylgruppe wird eine genau äquivalente Menge
an Protonen frei (Oxime sind sehr schwache Basen!) nach:
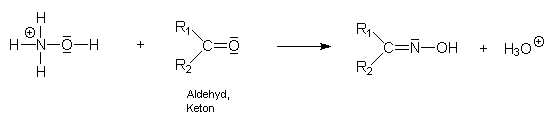
Die freigesetzten Protonen können anschließend mit äthanolischer Kalilauge (z.B. KOH 0,5 N) gegen Bromphenolblau titriert werden. Leider ist der Farbumschlag nicht sehr scharf, deshalb wird ein Blindwert (nur mit Reagenslösung) erhoben. Auch ist einige Übung bei der Durchführung empfehlenswert.
Gehaltsbestimmung
Hier macht man sich zunutze, daß Hydroxylamin in kochender saurer Lösung dreiwertiges Eisen (Fe+III) in zweiwertiges (Fe+II) zu reduzieren vermag. Dabei bildet sich Distickstoffmonoxid:
2 NH2OH + 4 Fe 3+ ![]() N2O +
4 Fe 2+ + 4 H
N2O +
4 Fe 2+ + 4 H![]() + H2O
+ H2O
Das so gebildete Fe2+ kann mit Kaliumpermanganat-Maßlösung (0,1 N KMnO4) titriert werden. Dabei wird es wieder zum dreiwertigen Eisen oxidiert nach der Gleichung:
MnO4![]() + 5
Fe 2+ + 8 H
+ 5
Fe 2+ + 8 H![]()
![]() Mn 2+ + 5 Fe 3+ + 4 H2O
Mn 2+ + 5 Fe 3+ + 4 H2O
| Gefahrenzeichen: | N ,Xn |  |
| R-Sätze | R 22 | Gesundheitsschädlich beim Verschlucken |
| R36/38 | Reizt die Augen und die Haut | |
| R 43 | Sensibilisierung durch Hautkontakt möglich | |
| R 48/22 | Gesundheitsschädlich: Gefahr ernster Gesundheitsschäden bei längerer Exposition durch Verschlucken | |
| R 50 | Sehr giftig für Wasserorganismen | |
| S-Sätze | S 2 | Darf nicht in die Hände von Kindern gelangen |
| S 22 | Staub nicht einatmen | |
| S 24 | Berührung mit der Haut vermeiden | |
| S 37 | Geeignete Schutzhandschuhe tragen | |
| S 61 | Freisetzung in die Umwelt vermeiden. Besondere Anweisungen einholen / Sicherheitsdatenblatt zu Rate ziehen | |
| Lagerkategorie: | 13 | lagern ohne Einschränkung |
| Deutsche Wassergefährdungsklasse: | WGK 2 | Wassergefährdender Stoff |
| Schweizer Giftklasse | CH 3 | Giftige Stoffe |
Literaturhinweise:
BÖHME/HARTKE, Deutsches Arzneibuch 7. Ausgabe 1968, Kommentar, S. 190ff (Wiss. Verlagsges. mbH, Stuttgart, GOVI-Verlag Frankfurt)
Deutsches Arzneibuch 9. Ausgabe, Kommentar, S. 469
Pharmacopoea Europaea Suppl. 1999, S. 192, Reagenzien H

[Homepage] * [zurück zur alphabetischen Preisliste]
Erstellt am 28.04.2000 * Letzte Änderung des Dokuments am 19.04.2002