![]()
Vorkommen:
Harnstoff ist das Endprodukt des Eiweißstoffwechsels. Er wird in der Leber gebildet und gelangt über das Blut und die Nieren in den Harn. Der Mensch scheidet mit dem normalen Tagesurin etwa 30 g Harnstoff aus. Harnstoff kommt auch in vielen Pflanzen, besonders in Pilzen, vor.Chemische und physikalische Kenndaten
Summenformel: CH4N2O
Strukturformel:
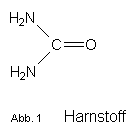
Molekülmasse / F.W. 60,06 g/mol
Dichte / s.g. 1,335
Schmelzpunkt / m.p. 132,7 °C (Schmelzbereich der Handelsware zwischen 132 und 135 °C)
Zersetzung: Thermische Zersetzung ab 132 °C
Löslichkeit in Wasser: 1080 g/l (bei 20 °C); in Ethanol 96%: löslich in etwa
5 Volumenteilen
Beschreibung
Harnstoff bildet farb- und geruchlose, salpeterartig schmeckende Kristalle (tetragonale Prismen), die in Wasser und Ethylalkohol leicht löslich sind. Beim Erhitzen auf etwa 140 OC zersetzt sich der Stoff unter Bildung von Biuret. Dabei entsteht zunächst Isocyansäure, die mit weiterem Harnstoff zusammen zu Biuret weiterreagiert:
H-N=C=O + H2N-CO-NH2 |
==> |
H2N-CO-NH-CO-NH2 |
Isocyansäure + Harnstoff |
Biuret |
Bekannt geworden ist die Biuret-Reaktion, da sich damit Eiweißkörper nachweisen lassen (siehe im Abschnitt Chemische Eigenschaften und Reaktionen). In Äther oder Chloroform ist die Substanz schwer löslich. Beim Lösen in Wasser beobachtet man eine starke Abkühlung. Harnstoff ist hygroskopisch (zieht Luftfeuchtigkeit an). Chemisch handelt es sich um das Diamid der Kohlensäure. Im Vergleich dazu ist die Carbamidsäure, das Monoamid der Kohlensäure, nicht stabil, da an Stickstoff gebundene Carboxylgruppen meist sofort Kohlendioxid abspalten:
H2N - COOH --------> CO2 ^ + NH3 ^
Carbamidsäurezersetzung
Geschichte
Harnstoff wurde bereits im Jahre 1729 von BOERHAVE und erneut 1773 von ROQUELLE (1718 bis 1778), dem Apotheker des Herzogs von Orleans, im menschlichen Harn entdeckt. 1797 stellten FOURCROY und VAUQUELIN mit ihm eingehendere chemische Untersuchungen an.
Besonders bekannt geworden ist die erstmalige Herstellung von Harnstoff durch FR. WÖHLER (1800-1882) im Jahre 1828 aus dem Salz Ammoniumcyanat. Die historische Bedeutung dieser einfachen Synthese liegt darin, daß damit bewiesen war, daß für die Erschaffung einer organischen Substanz keine mystische "vis vitalis" erforderlich ist. Ein "Produkt des Lebens" war also außerhalb eines lebenden Körpers hergestellt worden. Diese Reaktion wird auch heute noch technisch zur Gewinnung von Harnstoff eingesetzt:
![]()
Eine andere Herstellungsmöglichkeit besteht in der Umsetzung von Kohlendioxid mit Ammoniak bei 150 OC und hohem Druck (50 bis 100 bar). Das sich zwischendurch bildende carbaminsaure Ammonium zerfällt in Harnstoff und Wasser.
Anwendung
Harnstoff gilt in ca. 2%igen Zubereitungen als granulationsfördernd (als Granulationsgewebe bezeichnet man das typische junge, gefäßreiche Bindegewebe, das bei der Wund- und Geschwürsheilung bzw. bei chronischen Entzündungen gebildet wird und sich nach einiger Zeit in Narbengewebe umbildet). Über den Wirkungsmechanismus hierfür ist nichts bekannt.
In höheren Konzentrationen (5-10%) nutzt der Hautarzt den hygroskopischen (wasseranziehenden) Effekt des Harnstoffs aus, z.B. bei der Behandlung der Ichthyosis ("Fischschuppenkrankheit"), der Schuppenflechte (Psoriasis) und der Neurodermitis (atopisches Ekzem). Hygroskopische Substanzen, in erster Linie Harnstoff, halten als natürliche Feuchthaltefaktoren die Feuchtigkeit in der Hornhaut zurück. Sinkt der Wassergehalt in der Hornschicht (verursacht durch einen Harnstoffmangel) unter 15%, z.B. bei der Neurodermitis atopica, wird die Haut trocken, spröde und rissig. Ähnlich wie beim atopischen Ekzem fehlt auch bei der Schuppenflechte Harnstoff in der Epidermis. Die Folge ist eine starke Austrocknung der befallenen Hautfächen.
In kosmetischen Hautpräparaten verwendet man Harnstoff als in der Haut feuchtigkeitsbindende Substanz (1 bis 2%ig). Eine 10%ige wäßrige Lösung von Harnstoff ist bakterientötend. Schließlich wirkt Harnstoff - was man sich sowohl in Pharmazie wie auch Kosmetik zunutze machen kann - keratolytisch bzw. keratoplastisch (erweichender Effekt auf das Keratin der Haut) sowie juckreizmildernd. Durch seine polare Struktur hält er das Wasser in der Haut fest und bewahrt ihr dadurch Glätte und Geschmeidigkeit.
REZEPT: Liposomen-Lotion mit Harnstoff (gegen unreine Haut)
1)
2)
3)
Früher verwendete man Harnstoff als Mittel, die Harnaussscheidung zu steigern (Diuretikum bei Leberzirrhose und Brustfellentzündung). Eine besondere medizinische Einsatzmöglichkeit ist die Verwendung als Antidot (Gegenmittel) bei Vergiftungen mit Formaldehyd. Technisch kann die Substanz aufgrund ihres hohen Stickstoffgehaltes (46% N) als Dünger eingesetzt werden. Vom Harnstoff leiten sich auch spezielle Düngersorten ab, die ihren Nährstoffgehalt nur langsam in zweckmäßig verteilter Dosierung während der ganzen Wachstumsperiode der Pflanze abgeben. Diese Depotdünger sind deswegen von besonderer Bedeutung, weil bei übermäßigen Niederschlägen von den Hauptnährstoffen der Stickstoff besonders stark ausgewaschen wird. In der Landwirtschaft auch benutzt als Eiweiß-Supplement in Futtermitteln für Wiederkäuer.
Weiterhin nutzt man Harnstoff als Ausgangsstoff für Kunstharze (Aminoplaste), für Leimharze, Klebstoffe für die Holzindustrie, Papierhilfsmittel, Entparaffinierung von Erdölfraktionen. Besondere Bedeutung besaß der Grundstoff früher als Baustein von Schlafmitteln der sog. Ureidklasse (Carbromal, Acecarbromal).
Chemische Eigenschaften und Reaktionen
Harnstoff hat basische Eigenschaften, welche allerdings nur schwach ausgeprägt sind (pKB= 13,9). Aufgrund des besonders energiearmen Grundzustandes des Endprodukts erhält man dennoch mit konzentrierter Salpetersäure ein stabiles, kristallines Mononitrat.
Bei der Hydrolyse (Spaltung unter Wasseraufnahme), die durch Alkalien oder Säuren katalysiert wird, bilden sich entweder Alkalicarbonat und Ammoniak oder Kohlendioxid und Ammoniumsalz. Sehr leicht verläuft die Hydrolyse mit dem Enzym Urease, das in Sojabohnen vorkommt. Urease kann zur Identifizierung von Harnstoff dienen, da das dabei entstehende Ammoniakgas analytisch leicht nachgewiesen werden kann.
VERSUCHE:
Löse etwas Harnstoff in Wasser auf und füge etwa 5 bis 10 Tropfen starker Natronlauge hinzu. Koche und prüfe die aufsteigenden Dämpfe auf entweichendes Ammoniak. Säure die zurückbleibende alkalische Lösung mit Salzsäure an. Es entweicht Kohlendioxid aus dem in Lösung vorhandenen Natriumcarbonat (Soda).
Erhitze 10 ml Harn in einem Erlenmeyerkolben mit Barytwasser [Ba(OH)2]. Ein über die Mündung gehaltener Streifen feuchten roten Lackmuspapieres wird durch das entweichende Ammoniak gebläut. Gleichzeitig trübt sich die Flüssigkeit durch ausgeschiedenes Bariumcarbonat.
Versetze eine neutrale Harnstofflösung in Wasser in einem verschließbaren Kolben mit etwas Sojabohnenpulver. Das Gefäß wird verschlossen eine halbe Stunde lang bei normaler Temperatur stehengelassen. Danach prüfe auf Ammoniakgeruch, alkalische Reaktion der Lösung (Ammoniumcarconat!) und füge wieder Salzsäure hinzu, wobei Kohlendioxid entweicht.
Die Zersetzung von Harnstoff zu Biuret wurde oben bereits angesprochen.
VERSUCH (Biuret-Reaktion):
In einem Reagenzglas werden zu etwa 2 ml Eiweißlösung 1 ml 10%ige Natronlauge gegeben, sodann geschüttelt und etwa 3 Tropfen einer 3%igen Kupfersulfatlösung hinzugefügt. Die Flüssigkeit nimmt eine schöne rotviolette Färbung an. Feste Eiweißstoffe, wie sie etwa in Wurst, Brot, Haaren, Federn usw. vorkommen, müssen vor dieser Reaktion durch Kochen mit Natronlauge ganz oder zumindest teilweise aufgelöst werden (nach dem Aufkochen warten, bis die Lösung abgekühlt ist, da sonst schwarzes Kupferoxid ausfällt!). Die Biuret-Reaktion wird durch die Peptidbindung -CO-NH- ausgelöst, die für alle Eiweißkörper charakteristisch ist. Diese Bindung liegt auch beim Harnstoff vor. Im Übrigen wird die Reaktion ausgelöst beim Vorhandensein von mindestens 2 der folgenden Gruppen: -CS-NH2, -C(=NH)NH2, .CH2NH2
Harnstoff kann als Diamid der Kohlensäure aufgefaßt werden. Als solches reagiert er mit salpetriger Säure zu Stickstoff:
H2N-CO-NH2 + 2 HONO ==> CO2 ^ + 2 N2 ^ + 3 H2O
Hier reagiert Harnstoff vergleichbar wie Ammoniak, Stickstoffwasserstoffsäure und Amidosulfonsäure. Diese Zersetzung von Nitrit ist bei der Analyse wichtig, da Nitrate nur dann nachgewiesen werden können, wenn Nitrit abwesend ist. Dazu wird der Säureauszug oder die neutrale Lösung der Analysensubstanz kalt mit einer Harnstofflösung versetzt und ganz schwach angesäuert. Nitrit zersetzt sich dann schnell unter Bildung von Stickstoff.
Quantitative Bestimmung des Harnstoffs
Die verschiedenen Methoden der Gehaltsbestimmung sind für Harnanalysen wichtig. Meist unterwirft man Harnstoff der (oben beschriebenen) enzymatischen Hydrolyse durch Urease und bestimmt das abgespaltene Ammoniak titrimetrisch. Nach VAN SLYKE kann alternativ der bei der Einwirkung von salpetriger Säure entstehende Stickstoff volumetrisch gemessen werden.
Biochemischer Anhang
Überschüssige Aminosäuren, die im Stoffwechsel des menschlichen Organismus nicht für den Aufbau von Eiweißstoffen (Proteinen) und anderen biologisch wichtigen Molekülen verwendet werden, können im Körper - anders als Fettsäuren und Traubenzucker - nicht gespeichert werden. Allerdings werden sie auch nicht ausgeschieden, sondern finden für weitere Stoffwechselprozesse Verwendung.
Dabei werden die meisten stickstofftragenden Aminogruppen dieser überzähligen Aminosäuren zu Harnstoff umgewandelt, und ihr Kohlenstoffgerüst dient zur Bildung von Fettsäuren, Ketonkörpern und Traubenzucker (Glucose). Der Abbau der Aminosäuren sowie die Harnstoffsynthese findet bei Säugetieren hauptsächlich in der Leber statt.
Erstellt am 04.01.1999 * Letzte Änderung am 11.07.1999
![]()
[Index] * [Homepage] * [Produktbeschreibung] * [Literaturhinweise] * [Zur Preisliste]