Riechstoff-Lexikon
![]()
Vanillin
Andere Bezeichnungen: Vanillaldehyd, 4-Hydroxy-3-methoxybenzaldehyd,
Methyl-Protocatechualdehyd; engl.: Vanillin, 4-hydroxy-3-methoxybenzaldehyde,
Methylprotocatechuic aldehyde, vanillic aldehyde
|
Arctander
[1]: |
3067 |
|
FEMA-Nummer: |
3107 |
|
EG-/EINECS-Nummer:
|
204-465-2 |
|
CAS-Nr.: |
[121-33-5] |
|
HS-Nr.: |
2912 41 00 |
Vorkommen:
Der Duftstoff kommt in der
Natur vielfach vor, man kennt ihn als Bestandteil von ätherischen Ölen,
Absolues (u.a. Jasmin) und von natürlichen Aromen. Nicht bei jeder Pflanze, in
der der Stoff enthalten ist, ist er auch bestimmend für den jeweiligen Duft
bzw. Aroma, doch dominiert der Aldehyd ganz eindeutig den wohlbekannten
Geruchs- und Geschmackseindruck bei den Vanillearten; insbesondere sind hier zu
nennen Vanilla planifolia ANDR.
und Vanilla
tahitensis (Familie der Orchidaeae).
Vanillin kommt in den Früchten dieser Schlingpflanzen gebunden an Glucose vor
(Vanillosid, ein sog. Glucosid); die unreifen Früchte werden durch Eintauchen
in heißes Wasser oder Anwelkenlassen abgetötet und danach für 1-2 Wochen in
einer feucht-warmen Umgebung fermentieren gelassen. Das Glucosid wird dabei
unter Bildung von Vanillin
aufgespalten. Bemerkenswert ist auch sein Einfluß auf den Duft von Tolubalsam,
Perubalsam und Benzoe
Siam/Sumatra. Im Tierreich erscheint Vanillin als Insektenlockstoff (Pheromon)
männlicher Wanzen der Art Eurygaster
integriceps.
Beschreibung:
Vanillin bildet farblose
oder crèmefarbene bis hellgelbe, meist prismatisch-nadelförmige Kristalle, die
in Ethanol gut löslich sind. Auch Ether, Chloroform, Pyridin,
Schwefelkohlenstoff, andere organische Lösungsmittel sowie konzentrierte
Essigsäure vermögen es gut zu lösen. In Wasser von Raumtemperatur löst sich
Vanillin eher schlecht (etwa 1 g in 100 ml), in heißem Wasser von 80 °C dagegen
besser (ca. 5 g in 100 ml). Unter dem Einfluß von Licht und feuchter Luft
zersetzt sich der Aromastoff langsam unter Braunfärbung (Bildung von
Dehydrodivanillin bzw. Oxidation zu Vanillinsäure). Der Einsatz in der
Seifenparfumerie ist daher problematisch (Mögliche Verfärbung der Endprodukte).
Vanillin sublimiert unzersetzt.
Duftprofil:
Ausgeprägter und
charakteristischer Duft und Geschmack nach Vanille, süßlich. Beinoten:
"sahnig", "schokoladig", caramelartig.
engl./odor profile: intense, sweet, fragrant, typical odor and taste of
vanilla, chocolate-like, malty, caramel
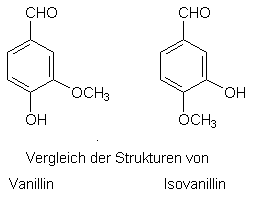
Der Vergleich von
Dufteindruck und molekularer Struktur bietet oftmals aufschlußreiche Einblicke
in "Struktur-Wirkungs-Beziehungen". Während der Riechstoff Vanillin
süß-balsamisch duftet, weist das isomere Isovanillin (in der Abb. rechts) einen
kaum merkbaren Geruch auf.
Verwendung:
Vanillin wird in der
Parfumerie weithin verwendet, und zwar nicht nur als Fixateur, sondern auch als
Modifikateur und zur Abrundung von Kompositionen der Richtung süß-balsamisch.
Der Riechstoff harmoniert gut mit "Heliotrop"- und "Sweet
Pea"-Düften, Cumarin und Benzylisoeugenol.
Wichtiger Aromastoff in der
Lebensmitteltechnologie (z.B. für Schokoladenprodukte, Speiseeis, Liköre,
Backwaren, Süßigkeiten, Vanillinzucker) und für Arzneimittel. Die Substanz ist
daher in den entsprechenden Vorschriftensammlungen monographiert (wie Food
Chemicals Codex 5th ed., Pharmacopoea Europaea 7. Ausgabe).
Aufgrund der vielseitigen
Umsetzbarkeit ist Vanillin auch Ausgangsstoff bzw. Zwischenprodukt für die
Synthese von pharmazeutischen Produkten, zu nennen ist vor allem die
Herstellung von L-DOPA, Methyldopa und Papaverin. Technische Verwendung: Als
Glanzzusatz beim galvanischen Verzinken.
In der analytischen Chemie
dient Vanillin u.a. zum Nachweis von freier Salzsäure im Magensaft (Bestandteil
von GÜNZBURGS Reagenz [5]) und als Reagenz für die
Clemmensen-Reduktion von Aldehydgruppen [20].
Darstellung:
Vanillin wird im
wesentlichen auf zwei Arten gewonnen, deren Ausgangsmaterialien und Verlauf
allerdings recht verschieden sind. Es wird auf die Fachliteratur verwiesen.
Chemische Umsetzungen:
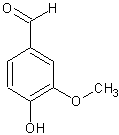
Vanillin ist 4-Hydroxy-3-methoxybenzaldehyd
und weist somit 3 verschiedene funktionelle Gruppen auf: eine Aldehydgruppe,
eine phenolische Hydoxygruppe und eine Etherfunktion (Methoxygruppe).
Entsprechend vermag die Substanz zahlreiche chemische Reaktionen einzugehen,
nicht zuletzt ist auch ein Angriff am reaktiven benzolischen Grundkörper möglich.
Mit Dimethylsulfat erfolgt Verätherung zu 3,4-Dimethoxybenzaldehyd
(Veratrumaldehyd), auch ist die Demethylierung erwähnenswert. Katalytische
Hydrierung führt zu Vanillylalkohol bzw. zu 2-Methoxy-4-methylphenol; Oxidation
unter Schutz der OH-Gruppe läßt Vanillinsäurederivate entstehen.
Aufbewahrung:
Dicht verschlossen, vor
Licht und Wärmeeinwirkung geschützt zu lagern.
Chemische und physikalische
Kenndaten:
Molmasse Mr = 152,15 g/mol
Summenformel (Linienformel): C8H8O3
Strukturformel:
Chemische und physikalische Kenndaten der Substanz:
|
Parameter |
Wert (z.B. Roth/Kormann, Römpp, Bauer et al.) |
Bereich (FCC, [7]) |
|
Dichte 20 °C / s.g. |
1,056 (liq.) |
--- |
|
Schmelzpunkt / mp |
82-83 °C |
81-83 °C (auch DAB 7) |
|
Siedepunkt / bp |
263 °C (1.3 kPa); 170 °C
(20 mbar); 155 °C (Kp13) |
--- |
|
Löslichkeit in Ethanol |
klar löslich L96% |
klar löslich L96% |
|
Löslichkeit in Methanol |
0,1 g/ml klar löslich |
--- |
|
Trocknungsverlust |
--- |
max. 0,5% |
|
Glührückstand |
--- |
max. 0,05% |
|
Grenzwerte für Arsen und
Schwermetalle |
--- |
entsprechend |
Gehaltsbestimmung:
Bedingt durch die Substituenden ist Vanillin eine stärkere Säure als
Phenol und kann alkalimetrisch in wäßrigem Medium gegen Thymolphthalein als
Indikator titriert werden. Im Folgenden ist die Arbeitsvorschrift des DAB 7
wiedergegeben [5]:
0,30 g Substanz, genau
gewogen, werden unter Erwärmen in 50 ml Wasser gelöst. Nach dem Abkühlen und
Zusatz von 0,30 ml Thymolphthalein-Lösung (I 25) wird mit 0,1 N-Natronlauge (V
22) bis zum ersten Farbumschlag titriert.
1 ml 0,1N - Natronlauge
entspricht 15,22 mg C8H8O3.
Herstellung der Thymolphthalein-Lösung
(I 25): 50 mg Thymolphthalein (R 455) werden unter schwachem Erwärmen in 50 ml
Äthanol 90% (R 12) gelöst. Die Lösung wird mit Wasser zu 100 ml aufgefüllt.
Umschlagsintervall: pH 9.3 bis
10.5.
![]()
Unsere hiermit gegebenen
Informationen sind mit Sorgfalt erarbeitet und nach bestem Wissen zusammengestellt
worden. Eine Gewähr für deren Richtigkeit kann jedoch nicht gegeben werden,
Irrtum und Änderungen bleiben vorbehalten. Eine eventuelle Anwendung,
Verwendung und Verarbeitung der beschriebenen Produkte liegen ausschließlich im
Verantwortungsbereich des Verwenders.
Erstellt am 03.05.1999 * Letzte Änderung am
01.09.2013